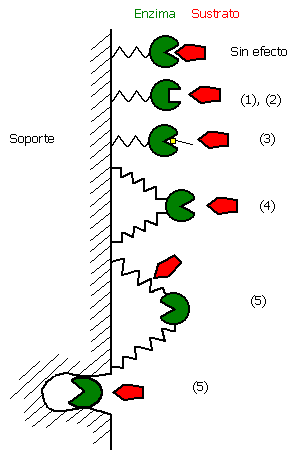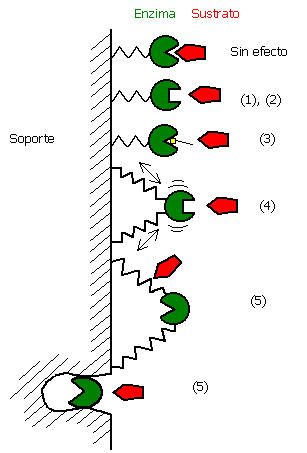
Efectos de la inmovilización de enzimas
La inmovilización se puede considerar con un proceso de unión aleatorio que, por esta razón, puede afectar negativamente el sitio activo de una enzima en varios grados, aun en el mismo proceso de inmovilización. Se ha observado, en general, una baja actividad específica de las enzimas inmovilizadas. El grado de retención de la actividad, depende del método de inmovilización empleado. Las razones más importantes por las cuales una enzima pierde su actividad se resumen a continuación y se ilustran en la siguiente figura:
Efectos de la inmovilización enzimática

Los efectos sobre el microambiente enzimático, a pesar de que se sabe que la inmovilización afecta la conformación y produce efectos estéricos, no se han estudiado debidamente, por la dificultad para determinarlos.
Los valores cinéticos inherentes, publicados para algunas enzimas inmovilizadas, no presentan variación respecto a los valores intrínsecos (enzima libre), aunque resulta lógico pensar que el ambiente en el cual se encuentra la enzima, afecta de alguna forma su actividad. Un soporte que presente o no, afinidad por un sustrato, puede hacer que la enzima aumente o disminuya esta afinidad. La existencia de puentes de hidrógeno en el soporte, también puede originar cambios en la estructura enzimática causando alteraciones en su actividad. Goldman et al. (1968) al hidrolizar gelatina con papaína, encontraron que la actividad de la enzima libre era mayor que la de la enzima inmovilizada en nitrato de celulosa, pero el poder de hidrólisis de esta última era mayor, ya que se logró un 60% más de conversión.
Propiedades como la termoestabilidad, el pH, etc., pueden verse afectadas por la inmovilización, no tanto por la disminución real del efecto, si no por la protección que el soporte puede ejercer. La inmovilización de enzimas frecuentemente incrementa su estabilidad, debido probablemente a la estabilización de la estructura terciaria de la proteína. Algunos tipos de inmovilización, especialmente atrapamiento, pueden causar impedimentos estéricos tan grandes que originan una inactivación aparente de la enzima. El gran número de factores que producen cambios en la cinética intrínseca de la enzima, exige que para cada biocatalizador se determine la cinética real o inherente para así poder conocer y cuantificar la cinética efectiva.