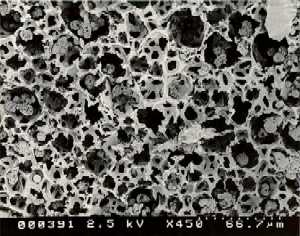
Los métodos más ampliamente usados de atrapamiento estructural, involucran la retención de células dentro de la red de una matriz polimérica (figura 1). La estructura es lo suficientemente compacta para prevenir la pérdida de células, pero permite la difusión de los sustratos y de los productos. La célula no está unida a la matriz, y la red polimérica se forma generalmente, en presencia de las células que van a ser inmovilizadas. Los poros hidrofílicos de las matrices se forman bajo condiciones lo suficientemente moderadas como para permitir la inmovilización celular con mínima pérdida de la viabilidad y de la actividad.
Figura 1. Fotografía que muestra células de riñón de hamster bebé (BHK) creciendo dentro de los poros de una matriz cerámica especialmente construida.

Las matrices más empleadas para el atrapamiento celular estructural son:
Gel de poliacrilamida
Este gel se usó para inmovilizar células completas en la primera aplicación exitosa de atrapamiento estructural para la producción de bioquímicos por biotecnología. La misma técnica se empleó en la producción de ácido L-aspártico. El método se basa en la polimerización por radicales libres en una solución acuosa de acrilamida monómero que contiene la células a baja temperatura. El grado de entrecruzamiento determina la porosidad y las propiedades mecánicas de las pastillas formadas. La gran desventaja de la técnica es la toxicidad del acrilamida monómero, del agente de entrecruzamiento (por ejemplo, N, N’ – metilenodiacrilamida [110-26-9]), y el iniciador de la polimerización (por ejemplo, N, N, N’, N’ – tetrametiletilenodiamina [110-18-9]; los cuales disminuyen la viabilidad celular y la actividad enzimática. El hidroxietil metacrilato [868-77-9] puede usarse como alternativa menos tóxica para acrilamida.
Alginato [9005-38-3]
Se extrae a partir de algas marinas y de cultivos de Azotobacter vinelandii; es un copolímero lineal del ácido b-D-manurónico y del ácido a-L-gulurónico unidos por enlaces 1, 4-glicosídicos. El alginato forma un gel en presencia de iones multivalentes, generalmente de calcio o aluminio. El atrapamiento controlado de las células es simple y generalmente, no es tóxico. Varios tipos de células pueden inmovilizarse con un pérdida despreciable de la viabilidad. Por lo anterior, la matriz puede solubilizarse en presencia de iones Ca2+ o agentes quelantes tales como, fosfatos, citratos o ácido etiléndiaminotetracético.
La matriz de alginato es mecánicamente débil, así que las células en crecimiento (en especial, las células vegetales) pueden desprenderse de las esferas o inclusive desintegrarse.
k - Carragenano [11114-20-8]
Es el polisacárido sulfonado de mayor disponibilidad, no es tóxico y posee un elevado peso molecular. Se extrae de algas marinas. Está compuesto por unidades de b -D-galactosa 4-sulfato y 3, 6-anhidro-D-galactosa. Únicamente la sal sódica del k - carragenano es soluble en agua fría. La inducción de la gelación con iones de potasio se puede realizar bajo condiciones moderadas y sin el uso de químicos que disminuyan la actividad enzimática. Otra de las ventajas de esta técnica consiste en que los biocatalizadores celulares inmovilizados pueden presentarse de diversas formas (pastillas, hojas, esferas, etc.)
Se dispone de dos procedimientos para el atrapamiento. Mediante el procedimiento de un solo paso se involiza un número considerable de células en el gel. La solución celular salina se mezcla con gel soluble de k - carragenano en condiciones estériles y finalmente las esferas se incuban en el medio nutriente. Otro método involucra el uso de resinas fotoentrecruzables. Los grupos activos (por ejemplo, los grupos vinilo) se acoplan a polietileno o a oligómeros de poli(propilenglicol) de longitud de cadena controlada para obtener prepolímeros. Dichos prepolímeros se mezclan con el cultivo celular y el entrecruzamiento se inicia con radiación UV. Las ventajas de este método son:
![]() El atrapamiento es simple y se
realiza bajo condiciones moderadas
El atrapamiento es simple y se
realiza bajo condiciones moderadas
![]() Los prepolímeros no contienen
monómeros tóxicos
Los prepolímeros no contienen
monómeros tóxicos
![]() La red del gel se puede adaptar a
las necesidades del proceso
La red del gel se puede adaptar a
las necesidades del proceso
![]() Se pueden lograr propiedades
fisicoquímicas del gel óptimas seleccionando los prepolímeros
más apropiados
Se pueden lograr propiedades
fisicoquímicas del gel óptimas seleccionando los prepolímeros
más apropiados
![]() Para saber más acerca de los compuestos
marcados con rojo vaya a ChemFinder, localizador de productos químicos.
Para saber más acerca de los compuestos
marcados con rojo vaya a ChemFinder, localizador de productos químicos.