Enlaces bioespecíficos
Las interacciones bioespecíficas entre las enzimas y otras especies moleculares (por ejemplo, lectinas o anticuerpos) también se utilizan para inmovilizar. Las lectinas tales como la concanavalina A [11028-71-0], son glicoproteínas, principalmente de origen vegetal, que enlazan fuertemente residuos específicos de un carbohidrato. Por ejemplo, una enzima que contiene un carbohidrato (L – ascorbato oxidasa) puede unirse específicamente al soporte comercial Concanavalina A – Sefarosa. El mismo método se ha usado para inmovilizar invertasa para la conversión continua de sucrosa.
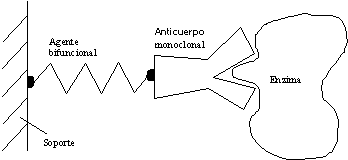
Un nuevo método para la preparación de enzimas inmovilizadas altamente activas, es enlazarlas con anticuerpos monoclonales específicos unidos a su vez a soportes.
Uso de anticuerpos monoclonales para inmovilización enzimática

La enzima está unida a un sitio específico bien definido sin que se vea afectada su actividad catalítica. La transglutaminasa (glutaminil-péptido g - glutamiltransferasa) [80146-85-6] se ha inmovilizado de esta forma por entrecruzamiento con lechos de gel de agarosa (AffiGel 10) para producir un biocatalizador bastante específico y muy activo, comenzando desde una preparación de la enzima cruda. En la inmovilización de la carboxipeptidasa A [11075-17-5], la enzima con la actividad más alta se logró con la utilización del par anticuerpo monoclonal de ratón – enzima soportado en Eupergit C (Röhm Pharma) o en una Proteína A – Sefarosa CL 4B (Pharmacia).
![]() Para saber más acerca de los compuestos
marcados con rojo vaya a ChemFinder, localizador de productos químicos.
Para saber más acerca de los compuestos
marcados con rojo vaya a ChemFinder, localizador de productos químicos.