1.
Modelo de inhibición competitiva
La inhibición es un mecanismo fundamental de regulación química de la actividad enzimática. En el caso de inhibición competitiva, el inhibidor y la molécula de sustrato compiten por el mismo sitio activo de la enzima. El inhibidor, que puede ser una especie inerte, un producto de la reacción o el mismo sustrato, se une con la enzima, en el sitio activo, formando un complejo no reactivo. El modelo de inhibición competitiva se fundamenta en las siguientes ecuaciones:
1. |
2. |
3. |
Donde, S, E, ES, I, EI y P representan el sustrato, la enzima, el complejo enzima – sustrato, el inhibidor, el complejo enzima – inhibidor y el producto, respectivamente; KS, KI son las constantes de disociación de los complejos enzima – sustrato y enzima – inhibidor, respectivamente.
La ecuación de balance de materia de la enzima es:
4. |
Donde, cE0, cE, cEI, cES, son las concentraciones de enzima inicial, de enzima libre de la enzima en el complejo enzima – inhibidor y de la enzima en el complejo enzima – sustrato, respectivamente. Si la ecuación anterior se divide por cE0, se obtiene:
5. |
Donde fE = cE/cE0, fEI = cEI/cE0, fES = cES/cE0
De la ecuación anterior:
6. |
Si las reacciones que conducen a la formación de los complejos EI y ES, están en equilibrio, la velocidad de la reacción, en condiciones estables, es:
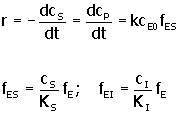 |
7. |
Donde, cS, cI son la concentración molar de sustrato e inhibidor, respectivamente. De la suma de las dos últimas expresiones se obtiene:
8. |
9. |
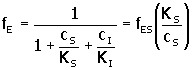 |
10. |
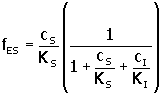 |
11. |
Si fES de la ecuación anterior se reemplaza en la ecuación de la velocidad de reacción, ecuación 7, se obtiene:
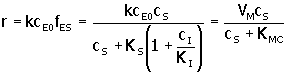 |
12. |
| 13. |
Donde, VM = kcE0 ; KMC es la constante de Michaelis, modificada para inhibición competitiva. El efecto de la inhibición competitiva es aumentar el valor de la constante aparente de Michaelis, sin alterar el valor de la velocidad máxima, VM, de la reacción.